A todos los que me apoyan y creen en mí, a los muchos o pocos lectores que tengo, a los que colaboran conmigo, a los que NO creen en mi, GRACIAS!
Un año, 365 días, 365 oportunidades de superarse o fracasar, de cometer errores y de aprendizaje. Muchos obstáculos en mi carrera profesional, siempre saliendo adelante con el apoyo de familia, amigos y pareja. Sin ellos no sería nada.
Que este año que comienza, que venga con más retos para superar, que nada sea fácil, ya que sería todo aburrido, no se sentiría el bello sabor de la satisfacción.
Este blog lo he echo con la finalidad de repasar, ayudar y aprender.
jueves, 31 de diciembre de 2015
miércoles, 30 de diciembre de 2015
¿QUÉ ES UN LIPOMA?
Un lipoma no es más que un tumor benigno, conformado por tejido adiposo.
Regularmente esté se da en personas adultas y rara vez en los niños. Constituyen el 6% de la totalidad de los tumores de partes blandas en pediatría. Estos suele ser uno o varios, cuando hay más de uno se le conoce como lipomatosis. Normalmente se presentan en el dorso del tórax, en las extremidades, en las zonas frontales y en las zonas occipitales.
Son visibles pues se presentan como una protuberancia en las zonas ya mencionadas, es suave, redondo y se mueve debajo de la piel, pues recordemos que son conformados por tejido subcutáneo o adiposo, regularmente no provocan dolor y su extracción es muy fácil; muy rara vez se convierten en tumorcillos malignos; se dan en la gente adulta entre los 40 y 60 años de edad.
Existen factores que aumentan la posibilidad de tener lipomas:
-Historial familiar.
-Obesidad.
-Golpe contundente o lesión en el cuerpo.
-Historial familiar.
-Obesidad.
-Golpe contundente o lesión en el cuerpo.
Los lipomas se pueden diagnosticar de diferentes maneras, el más común es el ultrasonido que son ondas sonoras que muestran una imagen en el monitor, el lipoma se localiza fácilmente y ayuda a tener una visión de lo que se encuentra al rededor de esté. La radiografía puede utilizase para localizar más lipomas en el cuerpo. Biopsia: se toma una pequeña cantidad del lipoma para mandarse a examinar,. hay que recordad que rara vez se puede convertir en un tumor maligno.
El tratamiento más común de un lipoma es la extracción, en la que el médico removerá el lipoma con un incisión en la piel, se utilizara un anestésico para adormecer el área de la cirugía.
El tratamiento más común de un lipoma es la extracción, en la que el médico removerá el lipoma con un incisión en la piel, se utilizara un anestésico para adormecer el área de la cirugía.
domingo, 20 de diciembre de 2015
Técnica de Seldinger.
 |
| Sven-Ivar Seldinger |
Fue descrito para ser utilizado principalmente para las angiografías, ahora se realizan procedimientos diagnósticos y terapéuticos mínimamente invasivos.
USOS.
*Angiografía.
*Drenaje de colecciones.
*Tunelizacióne de catéteres venosos centrales.
*Cateterización epidural.
EQUIPO Y MATERIAL.
Debe realizarse con la máxima asepsia, ya que conectamos el exterior con el espacio intravascular, con el riesgo de infección que ello conlleva.
-Gasas y paños estélites.
 -Solución antiséptica.
-Solución antiséptica.-Agujas y jeringa.
-Solución salina hepatinizada.
-Bisturí, seda y/o nylon.
-Aguja introductora, guía metálica flexible, dilatador .
-Catéter biocompatible.
-Sistema de perfusión.
TÉCNICA.
1.- Localizar el punto de punción mediante la palpación del pulso.
2.- Punción mediante aguja. La aguja debe de estar a 45° con fiador y cánula del calibre deseado. Se retira fiador, dejando la cánula plástica en el interior.
3.- Introducción de la guía. A través de la cánula se inserta la guía. Es necesaria para la inserción. avance, desplazamiento, posicionamiento, recolocación e intercambio de catéteres de forma segura.
4.- Paso del catéter, dilatador o introductor a través de la guía.
5.- Se retira la guía.
lunes, 21 de septiembre de 2015
Radiología Básica. Tele de Tórax. (Parte 1.)
 |
| Densidades Radiológicas. |
El estudio de las radiografías de tórax puede hacerse por 2 métodos:
el primero es la llamada observación libre en la cual el examinador se deja llevar por aquellos detalles que le llaman la atención y, al final, examinará la totalidad de la placa.
El segundo método de estudio es el de la búsqueda sistemática donde cada persona crea un orden especial para evaluar la radiografía. Es el más recomendado. Por ejemplo: tejidos blandos, estructuras óseas, vías aéreas -tráquea, bronquios-, hemidiafragmas, áreas subfrénicas, ángulos costo y cardiofrénicos, campos pulmonares- flujo vascular pulmonar-, hilios pulmonares, silueta cardiovascular.
La radiografía del tórax se presenta en tonos de gris que van desde el negro hasta el blanco.
Cinco densidades radiográficas son posibles, desde la más radiolúcida a la más radiopaca: aire, grasa, agua, hueso y metal. Los medios de contraste tienen densidad de metal, dado su contenido de yodo.
 |
| Imagen 1 (Neumotórax) |
Signos de pérdida de volúmen.
 |
| Imagen 2 (Atelectásia) |
Cuando hay lesiones radiopacas que muestran distribución segmentaria o lobar el único signo directo de pérdida de volumen es el desplazamiento de una cisura o de parte de ella siguiendo la opacidad.
La cisura que muestra un aspecto cóncavo
mirada desde fuera de la opacidad,
también indica pérdida de volumen.
Los signos de atelectasia pulmonar completa y que señalan la pérdida de volumen, son lógicamente mediastinales y nada tienen que ver con las cisuras.
 |
| Imagen 3 |
El desplazamiento del corazón hacia el lado izquierdo en las lesiones que producen disminución del volumen en la base izquierda, hacen que el perfil derecho de la parte inferior de la columna, normalmente cubierto por la aurícula derecha, aparezca descubierto, originando el signo de la columna desnuda (Imagen 4).
 |
| Imagen 4.Signo de la Columna Desnuda. |
Estrechamiento de los espacios intercostales.
Elevación del hemidiafragma (Imagen 5
 |
| Imagen 5. Elevación del Hemidiafragma. |
Desplazamiento de las arterias pulmonares y de los bronquios principales. Se encontrarán desviados hacia arriba en las lesiones que pierden volumen en el vértice y hacia abajo en las lesiones que lo hacen en la base.
Sobredistensión del parénquima pulmonar residual. El pulmón residual tiene la tendencia a llenar el máximo espacio posible. Por tanto los trazos vasculares se separarán, lo que se manifiesta en la radiografía como una disminución del flujo vascular pulmonar.
Desplazamiento de las líneas mediastinales hacia el lado de la lesión.
Lesiónes Radiopacas.
Ya que se está seguro que la lesión es radiopaca (más blanca que negra) y es focal, no difusa, sólo ocupa una porción determinada de un pulmón. Entonces, debes definir claramente los siguientes puntos mirando atentamente la lesión:
1. ¿Cúal es la forma de la opacidad ?
2. ¿Tiene distribución segmentaria o lobar?
3. ¿Tiene broncograma aéreo?
4. ¿Pierde, gana o conserva el volumen?
5. ¿Está localizada en el pulmón, la pared torácica o el mediastino?
6. ¿Cómo es la opacidad en su interior?
Radiopasidad absoluta unilateral.
 |
| Agenesia pulmonar. |
Si hay signos de ganancia de volumen dos posibilidades deben considerarse: derrame pleural masivo o gran masa que ocupa el hemitórax. El derrame casi siempre dejará un pequeño islote de parénquima pulmonar en el vértice pulmonar. La masa permite ver, con frecuencia, una parte de su perfil lo que ayudará a clasificarla como tal.
Es bastante lo que se tiene que ver en una Tele de Tórax, así que por el momento es todo, en estos días trataré de hacer la segunda parte.
Si realmente te interesó o simplemente quieres hacer una sugerencia, por favor, comenta.
"Compartir es Multiplicar."
viernes, 11 de septiembre de 2015
Síndrome de Marfan
 Bernard-Jean Antoine Marfan (1858-1942) nació en Castelnaudary (Languedoc-Rousillon) en 1958. Su padre, Antoine Prosper, era médico rural con pocos medios. Inicialmente trató de persuadir a su hijo de que estudiara medicina. Su madre fue Adelaïde Thuries.
Bernard-Jean Antoine Marfan (1858-1942) nació en Castelnaudary (Languedoc-Rousillon) en 1958. Su padre, Antoine Prosper, era médico rural con pocos medios. Inicialmente trató de persuadir a su hijo de que estudiara medicina. Su madre fue Adelaïde Thuries.
Es un trstorno del tejido conectivo. Los trastornos del tejido conectivo afectan los sistemas esqueléticos y cardiovascular, al igual que los ojos y la piel. Es una enfermedad autosómica dominante, lo que significa que ésta enfermedad tiene la misma probabiliad de aparecer en un sexo que otro y ser capaces de transmitirlo a la descendencia.
Se asocia al gen FBN1 del cromosoma 15, dicho gen codifica la proteina llamada Fibrilina, que es esencial para la formación de fibras elásticas del tejido conectivo.
Cuadro clínico.
El diagnóstico se basa principalmente en rasgos físicos.
Existen 3 tipos:
 |
| Sindrome de Marfan (imagen donada por @kjkjcastillo en Figure1) |
-Neonatal: ecocardiográficamente se puede detectar cardiomegalia con insuficiencia tricuspídea severa. Al momento de nacer se pueden apreciar malformaciones esqueléticas, en la piel y cardiovasculares. La muerte ocurre en horas o días por insuficiencia cardíaca.
-Infantil: existen lesiones cardiovasculares, predominando la dilatación aórtica. Como manifestaciones se aprecia el retardo de la marca y trastornos del aprendizaje.
-Clásico: es la forma más frecuente y se presenta en niños, adolescentes y adultos. El crecimiento esquelético sufre un crecimiento progresivo con la edad y parece estancarse al llegar a la adolescencia. Destaca el tamaño descontrolado de los huesos, aracnodactilia, escoliosis, hipermotilidad articular, paladar ojival, lesiones cardiovasculares con dilatación aórtica, lesiones oculares como desprendimiento de retina, desplazamiento del cristalino.
-Clásico: es la forma más frecuente y se presenta en niños, adolescentes y adultos. El crecimiento esquelético sufre un crecimiento progresivo con la edad y parece estancarse al llegar a la adolescencia. Destaca el tamaño descontrolado de los huesos, aracnodactilia, escoliosis, hipermotilidad articular, paladar ojival, lesiones cardiovasculares con dilatación aórtica, lesiones oculares como desprendimiento de retina, desplazamiento del cristalino.
domingo, 15 de marzo de 2015
Josef Mengele "El Angel de la Muerte"
1943 Auschwits, Polonia. Alentado por Von Verschuer, Josef Mengele solicitó el traslado al servicio de campo de concentración, donde esperaba tener la oportunidad de realizar investigaciones genéticas con humanos.
Nacido en Gunzburgo, Baviera el 16 de Marzo de 1911, hijo mayor de Karl y Walburga. josef terminó su educación en 1930 y comenzó a estudiar medicina y filosofía en la Universidad de Munich. En 1931 se unió a los Cascos de Acero, que era una organización paramilitar que fue absorbida en 1934 por las milicias nazis Sturmabteilung. En 1935 obtuvo el doctorado de antropología física en la misma universidad . En 1937, en el Instituto de Biología Hereditaria e Higiene Racial de Frankfurt, se convirtió en el asistente del Dr. Otmar von Verschuer, destacado cientifico conocido por sus investigaciones con gemelos. Allí Mengele se centró en los factores genéticos que resultaban en la aparición del labio leporino y la barbilla partida. En ese mismo año se unió al partido nazi, un año después se unió a las SS. En abril de 1943 lo ascendieron de rango de capitán. 30 de Mayo de 1943 trasladado al campo de concentración en Auschwits.
Durante su infame cargo en el campo de concentración, Josef Mengele no fue el único médico, alrededor de 30 más trabajaban con el.
Ansioso de hacerse un nombre por sí mismo comenzó a hurgar entre los secretos de la genética, ya que acorde con las ideas de Hitler, buscaba la imposición y el desarrollo de la raza aria, el modelo humano ideal para los nazis.
Según sus teorías, si de alguna manera la ciencia lograba asegurar que las mujeres arias dieran a luz gemelos rubios de ojos azules, el mundo se podría salvar, es decir, repoblar con esta raza "pura".
Genéticamente hablando, para Mengele los gemelos representaban un misterio. Y el campo de concentración al que había llegado era un sitio ideal donde obtener pacientes para sus experimentos, dada la gran cantidad de parejas de hermanos disponibles.
Mengele realizó experimentos sobre mas de 1500 pares de gemelos, de los cuales solo sobrevivieron unos 200 individuos. Los gemelos eran dispuestos por edades y sexo y encerrados en barracas, los experimentos variaban desde una inyección de diferentes químicos a los ojos de los gemelos para ver si podían cambiar los colores hasta literalmente intentar creas siameses. Además, a propósito se inyectaban enfermedades como tifus y tuberculosis en un gemelo y en otro no, cuando uno moría, el hermano era asesinado para comparar los efectos de la enfermedad.
Las prácticas de Mengele, que no tenían límites éticos, redundaron en el avance de la ciencia, pero a costa de las enfermedades, el sufrimiento y la muerte de muchísimos pacientes.
 |
| Josef Mengele "El Ángel de la Muerte" |
Durante su infame cargo en el campo de concentración, Josef Mengele no fue el único médico, alrededor de 30 más trabajaban con el.
Ansioso de hacerse un nombre por sí mismo comenzó a hurgar entre los secretos de la genética, ya que acorde con las ideas de Hitler, buscaba la imposición y el desarrollo de la raza aria, el modelo humano ideal para los nazis.
Según sus teorías, si de alguna manera la ciencia lograba asegurar que las mujeres arias dieran a luz gemelos rubios de ojos azules, el mundo se podría salvar, es decir, repoblar con esta raza "pura".
Genéticamente hablando, para Mengele los gemelos representaban un misterio. Y el campo de concentración al que había llegado era un sitio ideal donde obtener pacientes para sus experimentos, dada la gran cantidad de parejas de hermanos disponibles.
Mengele realizó experimentos sobre mas de 1500 pares de gemelos, de los cuales solo sobrevivieron unos 200 individuos. Los gemelos eran dispuestos por edades y sexo y encerrados en barracas, los experimentos variaban desde una inyección de diferentes químicos a los ojos de los gemelos para ver si podían cambiar los colores hasta literalmente intentar creas siameses. Además, a propósito se inyectaban enfermedades como tifus y tuberculosis en un gemelo y en otro no, cuando uno moría, el hermano era asesinado para comparar los efectos de la enfermedad.
Las prácticas de Mengele, que no tenían límites éticos, redundaron en el avance de la ciencia, pero a costa de las enfermedades, el sufrimiento y la muerte de muchísimos pacientes.
sábado, 7 de febrero de 2015
Síndrome Doege-Potter
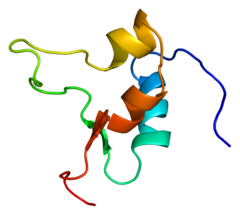 |
| Factor de crecimiento insulínico tipo 2 (IGF2) |
Caso clínico en México publicado en el 2009.
Caso clínico reportado en Chile en el 2012
Etiquetas:
factor de crecimiento insilinico tipo 2,
hipoglicemia,
igf2,
pleura,
Sindrome,
sindrome Doege Potter,
tumores fibrosos pancreaticos
martes, 3 de febrero de 2015
Síndrome de Moebius.
Sus causas son desconocidas, pero se han tenido evidencias obtenidas en necropsias y diferentes estudios como la tomografía o la resonancia y estudios clínicos, se ha visto que en la mayoría de los casos hay una agenesia de los núcleos de los pares VI y VII, o bien estos núcleos empiezan su desarrollo normalmente y más adelante en alguna etapa del desarrollo embriofetal, por algún evento isquémico, se destruye. Por otro lado, la presencia de metrorragias intensas durante el embarazo de madres con hijos con este síndrome es muy común. Por otro lado, en Brasil donde se ha observado una fuerte relación entre la aparición de este síndrome, cuyas madres hanian ingerido dosis masivas de misoprostol intentando abortar clandestinamente. Este medicamento es un análogo de la PGE-1 (Prostaglandina E 1), actúa sobre el útero gestante provocando contracciones en donde se produce una fuerte reducción de flujo sanguíneo uterino-fetal. En resumen las causas del síndrome de Moebius puede tener muchas causas (genética, factores teratógenos, anomalías placentarias, etc) en cualquier de los casos hay agenesia o destrucción de los núcleos de los pares craneales VI y VII, situados en el tronco cerebral.
Los síntomas más notables se presentan en las expresiones y funciones faciales. En recién nacidos hay una incapacidad de aspirar y babear en exceso, puede haber deformidades de lengua y mandíbula, estrabismo, problemas de oído y dentales.
No hay tratamiento curativo, pero requiere de un equipo multidisciplinario, desde médico pediatra hasta educadores, ya que es importante la integración social y laboral. El tratamiento existente es fundamentalmente quirúrgico.
lunes, 2 de febrero de 2015
Insomnio Familiar Fatal.
Se imaginan no poder dormir por horas, días, meses, hasta que tu cuerpo cae en un profundo coma del cual jamás podrás despertar?... Pareciera ciencia ficción, pero es realidad, una extraña enfermedad llamada Insomnio Familiar Fatal. Es un trastorno neurológico raro e infrecuente, que es hereditaria causada por priones, de herencia autonsómica dominante, se presenta a edad adulta, de espontanea aparición.
Se habló por primera vez de esta enfermedad en 1974, por el doctor italiano Ignazio Roiter, el encontró a dos mujeres que supuestamente habían muerto de insomnio. Buscando en los archivos de las familias, se dio cuenta que otros miembros habían muerto de la misma manera.
En una persona normal el sueño se divide en dos etapar, la REM (Rapid Eyes Movements; Movimiento Rápido de ojos) y la no REM. La etapa REM está relacionada con el sueño, la ensoñación y un umbral elevado de alerta; la etapa no REM se define como una etapa de descanso total, donde hay relajación muscular y baja tasa metabólica. para poder dormir se debe de inhibir el sistema reticular ascendente dada por el trabajo del sistema reticular descendente. En una persona con insomnio familiar fatal este sistema desaparece. Es por esto que el estado de alerta es permamente en la persona afectada.
Esta enfermedad tiene 4 etapas:
ETAPA 1. Inicio de la privación del sueño. Los pacientes sufren ataques de pánico, desarrollan fobias extralas y sufren de paranoia. Esta etapa se desarrolla durante 4 meses.
ETAPA 2. Comienzan a tener alucinaciones, seguidos de pánico, sudoración y agitación. Esta etapa tuene una duración de alrededor 5 meses.
ETAPA 3. Los pacientes sufren de insomnio total. Empiezan a perder peso rápidamente, sufren de incontinencia y empiezan a parecer mucho mas viejos. Esta tiene una diracion de 3 meses.
ETAPA 4. la etapa final. Los pacientes sufren de demencia total por la falta de sueño, incluso llegan a estar mudhos, Por último, se enfrentan a lo inevitable, la muerte síbita por la provación total del sueño. Esta etapa puede durar alrededor de 6 meses.
En la actualidad no existe tratamiento para esta enfermedad, son pocas las personas alrededor del mundo que la padecen.
Les dejo un documental muy interesante abajo.
Se habló por primera vez de esta enfermedad en 1974, por el doctor italiano Ignazio Roiter, el encontró a dos mujeres que supuestamente habían muerto de insomnio. Buscando en los archivos de las familias, se dio cuenta que otros miembros habían muerto de la misma manera.
En una persona normal el sueño se divide en dos etapar, la REM (Rapid Eyes Movements; Movimiento Rápido de ojos) y la no REM. La etapa REM está relacionada con el sueño, la ensoñación y un umbral elevado de alerta; la etapa no REM se define como una etapa de descanso total, donde hay relajación muscular y baja tasa metabólica. para poder dormir se debe de inhibir el sistema reticular ascendente dada por el trabajo del sistema reticular descendente. En una persona con insomnio familiar fatal este sistema desaparece. Es por esto que el estado de alerta es permamente en la persona afectada.
Esta enfermedad tiene 4 etapas:
ETAPA 1. Inicio de la privación del sueño. Los pacientes sufren ataques de pánico, desarrollan fobias extralas y sufren de paranoia. Esta etapa se desarrolla durante 4 meses.
ETAPA 2. Comienzan a tener alucinaciones, seguidos de pánico, sudoración y agitación. Esta etapa tuene una duración de alrededor 5 meses.
ETAPA 3. Los pacientes sufren de insomnio total. Empiezan a perder peso rápidamente, sufren de incontinencia y empiezan a parecer mucho mas viejos. Esta tiene una diracion de 3 meses.
ETAPA 4. la etapa final. Los pacientes sufren de demencia total por la falta de sueño, incluso llegan a estar mudhos, Por último, se enfrentan a lo inevitable, la muerte síbita por la provación total del sueño. Esta etapa puede durar alrededor de 6 meses.
En la actualidad no existe tratamiento para esta enfermedad, son pocas las personas alrededor del mundo que la padecen.
Les dejo un documental muy interesante abajo.
Suscribirse a:
Entradas (Atom)




